Thématiques - Traitement de l’eau
299.1.084 / V5
3 Dureté de l’eau
La dureté de l’eau est un paramètre d’une importance particulière dans le traitement ultérieur de l’eau de boisson. L’eau dure est largement répandue dans la nature et dans la distribution d’eau de boisson.
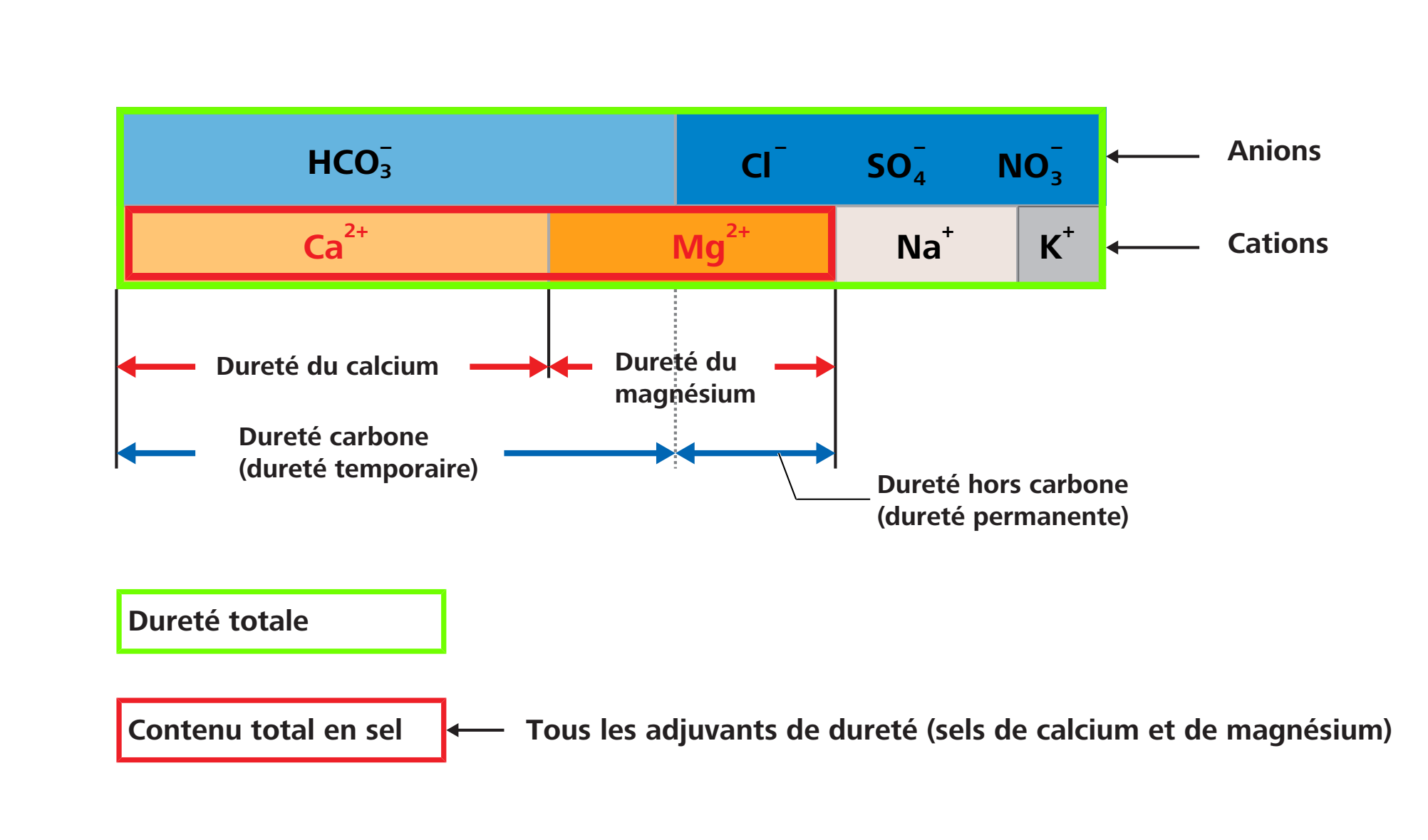
Dans la chimie de l’eau, on désigne par dureté de l’eau la concentration des métaux alcalino-terreux qui s’y trouvent dissous. Ce sont pour l’essentiel les ions de calcium et de magnésium qui contribuent à la dureté de l’eau car ils sont susceptibles de former des liaisons difficilement solubles. Les carbonates et hydrogénocarbonates p. ex. en font partie. Le calcium et le magnésium sont désignés collectivement aussi comme «agents de dureté».
La dureté totale de l’eau se définit comme la somme de la dureté carbonatée (dureté temporaire) et de la dureté non carbonatée (dureté permanente).
Les hydrogénocarbonates du calcium et du magnésium forment la dureté carbonatée et, lors du réchauffement de l’eau, ils se transforment en dépôts de calcaire. Les chlorures, nitrates et sulfates de calcium et de magnésium forment la dureté non carbonatée qui, lors du réchauffement de l’eau, ne subit pas de transformation.

En Suisse, on peut se renseigner auprès du fournisseur d’eau responsable pour connaître la dureté de l’eau.
3.1 D’où sort le calcaire que l’on trouve dans l’eau
L’eau de pluie s’enrichit en acide carbonique dans l’atmosphère. Cela a pour effet de dissoudre des sels calcaires dans les sols. La teneur en sels calcaires dissous varie selon la nature des sols. L’eau transporte ces liaisons de calcaire et d’acide carbonique dans l’installation d’eau domestique, p. ex. sous la forme d’hydrogénocarbonate de calcium. La concentration des sels calcaires dissous dans l’eau de boisson est le facteur déterminant pour la dureté de l’eau.
3.2 Niveaux de dureté de l’eau
Le système d’unités SI définit la dureté totale de l’eau en moles par litre (mol/l) ou millimoles par litre (mmol/l).
En Allemagne et en Autriche, la dureté de l’eau était par le passé mesurée en degrés de dureté allemande (°dH).
En Suisse, on utilise en général les degrés de dureté française (°fH).
La loi suisse sur les denrées alimentaires divise l’eau en 6 niveaux de dureté:
|
Désignation |
Dureté totale [mmol/l] |
Dureté totale [°fH] |
|---|---|---|
|
Très douce |
< 0.7 |
< 7 |
|
Douce |
0.7 … 1.5 |
7 … 15 |
|
Moyennement dure |
1.5 … 2.5 |
15 … 25 |
|
Assez dure |
2.5 … 3.2 |
25 … 32 |
|
Dure |
3.2 … 4.2 |
32 … 42 |
|
Très dure |
> 4.2 |
> 42 |
Niveaux de dureté de l’eau selon la loi suisse sur les denrées alimentaires
3.2.1 Conversion des unités de dureté de l’eau
|
mmol/l |
°fH |
°dH |
CaCO3 mg/l |
CaO mg/l |
|
|---|---|---|---|---|---|
|
mmol/l |
1 |
10 |
5.6 |
100 |
56 |
|
°fH |
0.1 |
1 |
0.56 |
10 |
5.6 |
|
°dH |
0.179 |
1.79 |
1 |
17.9 |
10 |
Exemple de conversion des unités de dureté de l’eau
|
CaCO3: |
le carbonate de calcium est un solide cristallin incolore. |
|
CaO: |
l’oxyde de calcium (appelé aussi chaud vive ou terre calcaire) est une poudre blanche qui, mêlée à de l’eau, dégage une forte chaleur. |
3.3 La nécessité d’un adoucissement de l’eau
On entend par adoucissement de l’eau l’élimination des ions de calcium (Ca2+) et de magnésium (Mg2+) dissous dans l’eau de boisson.
Vue sous l’angle d’une denrée alimentaire, l’eau ne nécessite pas d’adoucissement. Les ions de calcium et de magnésium dissous dans l’eau (agents de dureté) font partie des minéraux qui, s’ils sont inoffensifs pour nous, n’en sont pas moins vitaux.
Au niveau du goût, l’eau de boisson dure est souvent perçue comme étant meilleure que l’eau douce. L’eau douce a par contre la capacité de favoriser l’extraction des saveurs que contiennent le café et le thé.
Pour de nombreux autres usages toutefois, il s’avère que l’eau dure présente souvent des désavantages. Les agents de dureté sont susceptibles d’être une gêne partout où l’eau entre en contact avec des matières alcalines, en particulier avec des savons, ou encore là où elle est chauffée, portée à ébullition ou lorsqu’elle s’évapore.
Les machines et appareils sont toujours plus nombreux à fonctionner avec des technologies sophistiquées et sensibles. Or, il leur faut souvent une eau adoucie.
L’entartrage a pour raison principale le réchauffement de l’eau. Cela modifie l’équilibre naturel entre calcaire et acide carbonique, avec pour conséquence un dépôt de carbonate de calcium sous la forme de calcaire dur aux endroits les plus chauds. Les dépôts de calcaire sont d’autant plus importants que la température est élevée. Dans un même temps, pour des raisons hygiéniques et sanitaires, on ne peut renoncer à des températures élevées car autrement, on accroît le risque d’une prolifération de bactéries, p. ex. de légionelles.
3.3.1 Avantages d’une eau de boisson adoucie
Les principaux avantages d’une eau de boisson adoucie sont:
-
Protection des conduites contre un colmatage dans les conduites
-
Protection contre les déperditions d’énergie dans un chauffe-eau
-
Protection contre les dépôts de calcaire dans la salle de bain, sur les carrelages et composants sanitaires
-
Prévention de pannes par dépôt de calcaire dans les appareils domestiques
-
Allongement de la durée de vie des appareils domestiques
-
Absence de réparations coûteuses
-
Protection contre les dépôts de calcaire sur les verres et la vaisselle
-
Economie de détergents pour lave-vaisselle et lave-linge (jusqu’à 50 %)
-
Protection contre une lessive rugueuse ou des fibres cassantes dues à des savons calcaires
-
Effets positifs sur la peau et les cheveux lors de la toilette
-
Saveurs de café et de thé plus intenses
3.3.2 Désavantages d’une eau de boisson adoucie
Parmi les principaux désavantages d’une eau de boisson adoucie, on compte:
-
Risque de corrosion pour les conduites galvanisées et en cuivre. L’enlèvement de calcium et de magnésium a pour effet de libérer de l’acide carbonique (agressif) excédentaire.
-
Altération gustative de l’eau
-
Risque de contamination bactérienne de l’eau de boisson lorsque l’installation d’adoucissement n’est pas entretenue de manière appropriée
-
Pollution de l’environnement par un surcroît nuisible de sels dans les eaux usées lors de la régénération de la résine échangeuse d’ions
-
Frais courants (électricité, sel, entretien)
-
Perte de charge supplémentaire dans l’installation d’eau de boisson